糖尿病に関連する糖鎖合成酵素GnT-IVaの新たな仕組みを発見
2022年7月19日
糖尿病に関連する糖鎖合成酵素GnT-IVaの 新たな仕組みを発見
【本研究のポイント】
・タンパク質についた糖鎖に枝分かれを作る酵素GnT-IVaは、糖尿病への関与が指摘されているが、立体構造やタンパク質へ糖鎖を付ける仕組みの詳細はよくわかっていなかった。
・GnT-IVaは、糖鎖を作る領域の他に、糖鎖と結合する領域(レクチン)があり、特定の糖鎖と結合することで効率的な糖鎖合成を進めていることが分かった。
・本研究によって、糖鎖が作られる仕組みの解明や糖尿病の病態解明への応用が期待できる。
【研究概要】
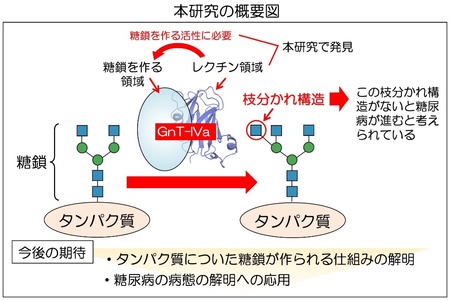
国立大学法人東海国立大学機構岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦教授らの国際共同研究チームは糖尿病にも関わる糖鎖合成酵素GnT-IVaの新しい反応機構を発見しました。GnT-IVaは、タンパク質の上の糖鎖に枝分かれ構造を作る酵素で、糖鎖を作るための領域の他に、これまで知れている糖鎖合成酵素には見られない、糖鎖と結合する領域(レクチン)があることを発見しました。さらに、その領域の立体構造を明らかにすることにより、レクチンが酵素活性に不可欠であり、特定の糖鎖と結合することで効率的な糖鎖合成をすすめていることを明らかにしました。本研究成果は、タンパク質の上に複雑な糖鎖が作られる仕組みの解明に重要な基礎的知見を与えるとともに、糖尿病の病態解明や治療法開発にも役立つことが期待されます。
本研究は、国立大学法人東海国立大学機構岐阜大学糖鎖生命コア研究所(iGCORE)の木塚康彦教授、国立大学法人大阪大学微生物病研究所の長江雅倫助教、学校法人東北医科薬科大学、国立研究開発法人産業技術総合研究所、University of Mississippiらのグループにより実施されました。
本研究成果は、2022年7月19日(火)18時(日本時間)にNature 姉妹誌Communications Biology誌のオンライン版で発表されました。
【画像:https://kyodonewsprwire.jp/img/202207204077-O4-Ail5T2I9】
【研究背景】
糖鎖1)とは、グルコースなどの糖(動物では約10種類の糖が存在)が枝分かれしながら鎖状につながったもので、多くはタンパク質や脂質などに結合した状態で存在しています。動物では、体内の半数以上のタンパク質に糖鎖がついています。タンパク質についている糖鎖には様々な形のものがあり、タンパク質ごとに形が異なることや、同じタンパク質でも、健康なときと病気のときとで糖鎖の形が変化することなどが知られています。こうした疾患特異的な糖鎖の変化は、実際に医療の現場でがんの診断などに使われています。また、特定の糖鎖が、がん、アルツハイマー病、糖尿病など様々な疾患において重要な役割を果たすことから、糖鎖を標的とした新たな治療薬の開発が期待されています。
タ ンパク質につく糖鎖は、細胞の中で糖転移酵素2)(糖鎖合成酵素)と呼ばれる酵素の働きによって作られます。180種類ほど存在しているヒトの糖転移酵素の一つとして知られるGnT-IVa3)は、細胞の中で、タンパク質についたN型糖鎖4)と呼ばれる糖鎖に作用し、糖鎖の枝分かれ構造を作ります(図1)。このGnT-IVaが作るβ1,4分岐と呼ばれる枝分かれ構造は、以前の研究で糖尿病の発症・進行と深い関係があることがわかっています。
【画像:https://kyodonewsprwire.jp/img/202207204077-O5-xMxlI7xM】
GnT-IVaは血糖調節に重要な臓器である膵臓に多く存在し、GnT-IVaを欠損させたマウスは高血糖やインスリン分泌不全などの糖尿病様の症状を示します。また、ヒトの膵臓においても、糖尿病に罹患するとGnT-IVaの発現が低下することなどから、GnT-IVaの活性を高めることは糖尿病の治療戦略の一つと考えられています。
このように、GnT-IVaの生体での機能が明らかになりつつある一方で、GnT-IVa自身の立体構造や、GnT-IVaがどのような機構でタンパク質の上の糖鎖を作るのか、という仕組みの詳細についてはよくわかっていませんでした。このような背景を踏まえ、木塚教授らは、GnT-IVaの立体構造に注目して、この仕組みの解明に取り組みました。
【 研究成果】 木塚教授らは、まずGnT-IVaのアミノ酸配列5)に着目しました。GnT-IVaは、一般的な糖転移酵素よりアミノ酸配列が長いことから、他の糖転移酵素とは異なるドメイン6)(領域)構造を持つことが示唆されました。Phyre2と呼ばれるタンパク質の立体構造を予測するツールを用いて調べたところ、GnT-IVaは糖鎖をつくる触媒7)ドメインの他に、C末端側にレクチンドメインと呼ばれる領域を持つことがわかりました(図2A)。レクチンとは、様々な糖鎖と選択的に結合するタンパク質のことで、GnT-IVaはC末端側のレクチンドメインで特定の糖鎖と結合することを示唆しています。そして、多くの糖転移酵素はこのようなレクチンドメインを持たないことから、GnT-IVaは他の酵素とは異なるユニークな仕組みで糖鎖を作ることが示唆されました。
【画像:https://kyodonewsprwire.jp/img/202207204077-O6-rZHQmvq9】
レクチンドメインのGnT-IVa酵素活性における役割を明らかにするために、まず、GnT-IVa、またはレクチンドメインを欠損させたGnT-IVaの変異体をそれぞれ細胞に発現させて精製しました。精製した酵素を、試験管の中で基質8)の糖鎖と混合し、生じた酵素反応の産物をHPLC(高速液体クロマトグラフィー)で分析しました(図2B左)。その結果、レクチンドメインを除いたGnT-IVaは、酵素活性を示さないことがわかりました(図2B右)。このことから、GnT-IVaのレクチンドメインは、酵素活性を発揮するのに不可欠であることが明らかになりました。
次に、レクチンドメインの働きや立体構造について、その詳細を調べました。レクチンドメインは糖鎖と結合する可能性が高いことから、どのような種類の糖鎖と結合するのか、N型糖鎖やO型糖鎖などを含む157種類の糖鎖を対象に、フロンタルアフィニティークロマトグラフィー9)と呼ばれる手法で調べました。その結果、GnT-IVaのレクチンドメインは、限られた構造を持つN型糖鎖とのみ結合することがわかりました(図3)。具体的には、GnT-IVaが作る枝分かれ構造を持ったN型糖鎖と特異的に結合しました。一方、GnT-IVaの基質となるような糖鎖や、伸長が進んでより複雑な形になった糖鎖とは結合しませんでした。またO型糖鎖など、他の種類の糖鎖とも結合しませんでした。このことから、GnT-IVaのレクチンドメインは、触媒ドメインが作った直後の産物糖鎖と結合することが明らかになりました。【画像:https://kyodonewsprwire.jp/img/202207204077-O7-35LFWhCb】
さらにレクチンドメインの役割の詳細を明らかにするため、精製したレクチンドメインを用いて、X線結晶構造解析10)という方法を使用し、その三次元構造を明らかにすることに成功しました(図4A)。さらに、明らかになった立体構造をもとにして、レクチンドメインが糖鎖とどのように結合しているかを明らかにするために、分子動力学シミュレーション11)という方法を使いました。その結果、上述の結果と一致して、GnT-IVaのレクチンドメインは、触媒ドメインが作る枝分かれ構造を持ったN型糖鎖と強く相互作用することがわかりました(図4B)。また、GnT-IVaの445番目のアミノ酸であるアスパラギン酸(D445)がこの相互作用に極めて重要であることもわかりました。【画像:https://kyodonewsprwire.jp/img/202207204077-O8-3oUTeZ8q】
最後に、GnT-IVaが実際に細胞内でタンパク質に働くときのレクチンドメインの役割を調べるため、レクチンドメインの糖鎖結合能に不可欠なアミノ酸(D445)をアラニンに置換し、レクチンドメインの機能を喪失させた変異体(D445A)を細胞に発現させて、その機能を調べました(図5)。DSA(Datura stramonium agglutinin、チョウセンアサガオレクチン)というレクチンを用いると、GnT-IVaがタンパク質の上に作る糖鎖を検出することができます。実際に、GnT-IVaおよびGnT-IVaと同じ糖鎖を作る活性を持つGnT-IVbという2つの酵素を欠損させて、GnT-IVの活性を完全になくした細胞(KO細胞)のタンパク質では、DSAとの反応性が大きく低下しており(図5B)、この方法でGnT-IVaが細胞内で作る糖鎖を検出することができます。このKO細胞に、通常のGnT-IVa(WT IVa)またはD445A変異体を発現させ、タンパク質の上に糖鎖がどの程度作られているかについてDSAを用いて調べました。その結果、D445A変異体を発現させると、WT IVaよりも細胞内でタンパク質の上に作られる糖鎖が少ないことがわかりました(図5B)。このことから、GnT-IVaが細胞内でタンパク質に効率的に糖鎖を作るためには、レクチンドメインと糖鎖との結合が必要であることが明らかになりました。
以上より、GnT-IVaは一般的な糖転移酵素とは異なりレクチンドメインを持っており、このレクチンドメインが触媒ドメインの作る糖鎖と選択的に結合することで、酵素の効率的な糖鎖合成を可能にしていることがわかりました。このことから、GnT-IVaのレクチンドメインは、(i)酵素反応過程で触媒ドメインが作った産物糖鎖を引き抜くのに働いているか、あるいは、(ii)複数のN型糖鎖の一部にGnT-IVaやIVbが作った分岐構造をすでに持つ糖タンパク質を捕捉するのに働いている可能性が考えられます(図6)。
【画像:https://kyodonewsprwire.jp/img/202207204077-O9-TsB7lPml】【画像:https://kyodonewsprwire.jp/img/202207204077-O10-3qh8m67r】
【今後の展開】
本研究により、GnT-IVaのレクチンドメインの構造や、このドメインを介したユニークな反応機構の存在が明らかになりました。また木塚教授らは最近、N型糖鎖の別の分岐構造を作るGnT-Vと呼ばれる酵素においても、触媒ドメインとは別のドメインを介して基質となるタンパク質を認識することを明らかにしています(https://www.gifu-u.ac.jp/about/publication/press/20220131.pdf)。これらの知見は、それぞれの糖転移酵素が独自の機構で基質タンパク質に作用して複雑な糖鎖を作り上げていることを示唆しています。一方、GnT-IVaのレクチンドメインと糖鎖との結合がどのようにして効率的な酵素反応に寄与しているのか、その詳細はまだ明らかになっていません。今後、触媒ドメインを含むGnT-IVa全体の立体構造がわかれば、GnT-IVaの働く仕組みがさらに解明されると期待されます。また本研究は、糖鎖一般においてまだ未解明である「タンパク質ごとに異なる糖鎖がつく仕組み」を考える上で重要な知見を与えるとともに、糖鎖が関わる糖尿病の発症の仕組み解明に貢献すると期待されます。
【論文情報】
雑誌名:Communications Biology
タイトル:Discovery of a lectin domain that regulates enzyme activity in N-acetylglucosaminyltransferase-IVa (MGAT4A)
著者:Masamichi Nagae, Tetsuya Hirata, Hiroaki Tateno, Sushil K. Mishra, Noriyoshi Manabe, Naoko Osada, Yuko Tokoro, Yoshiki Yamaguchi, Richard J. Doerksen, Toshiyuki Shimizu, and Yasuhiko Kizuka
DOI番号:10.1038/s42003-022-03661-w
論文公開URL:https://www.nature.com/articles/s42003-022-03661-w
【用語解説】
1)糖鎖:グルコース(ブドウ糖)などの糖が鎖状につながった物質。遊離の状態で存在するものもあれば、タンパク質や脂質に結合した状態のものもある。デンプン、グリコーゲンなどの多糖は数多くの糖がつながり、糖鎖だけで遊離の状態で存在する。一方タンパク質に結合したものは、数個から20個程度の糖がつながったものが多い。糖鎖が結合したタンパク質を糖タンパク質と呼ぶ。
2)糖転移酵素:糖鎖を合成する酵素のことで、ヒトでは180種類程度存在することが知られている。主に、細胞の中のゴルジ体と呼ばれる小器官に存在している。
3)GnT-IVa:糖鎖を合成する酵素(糖転移酵素)の一つで、細胞の中に存在し、β1,4分岐という糖鎖の枝分かれ構造を作る。
4)N型糖鎖:タンパク質につく糖鎖の種類の1つで、タンパク質のアスパラギン残基(アミノ酸の1文字表記でN)に結合している。ヒトでは7000種類以上のタンパク質がN型糖鎖を持つことがわかっている。
5)アミノ酸配列:タンパク質を構成する20種類のアミノ酸がどのような順番でつながっているかという情報。
6)ドメイン:タンパク質の構造の一部のうち、他の部分とは独立して折り畳まれた領域のこと。一般にタンパク質は複数のドメインからなる。
7)触媒:化学反応の速度を高める物質のこと。触媒自身は反応前後では変化しない。酵素は生体内の様々な反応を触媒するタンパク質である。
8)基質:化学反応における出発物質のこと。反対に、化学反応の結果できるものを生成物(産物)と言う。酵素は、自身が触媒する反応において、特定の構造を持った基質を厳密に認識することから、基質と酵素は鍵と鍵穴の関係に例えられる。
9)フロンタルアフィニティークロマトグラフィー:レクチンなどを固定化したカラムに様々な分子(本研究の場合は糖鎖)を流していき、糖鎖の溶出の遅れを指標にしてレクチンと各糖鎖の相互作用の強さを定量的に分析する手法。
10)X線結晶構造解析:原子レベルの立体構造を決定する手法の一つ。高純度で調製したタンパク質などを溶液中で結晶にして、X線を照射することで生じる回折現象を利用して構造を決定する。
11)分子動力学シミュレーション:Molecular Dynamics (MD)計算とも呼ばれ、分子や原子の動きを計算によって予測する方法。
【研究者情報】
木塚 康彦(きづか やすひこ):論文責任著者
岐阜大学糖鎖生命コア研究所糖鎖分子科学研究センター 教授(センター長)
















