FRONTIER BIOTECHNOLOGIESが初のコロナウイルスメインプロテアーゼ(MPRO)低分子阻害剤の第1相試験における良好な結果を発表
AsiaNet 97371
• FB2001(Bofutrelvir)は、イン・ビトロおよびイン・ビボ試験で強力な抗SARS-CoV-2活性を示すコロナウイルスメインプロテアーゼ(M-Pro)阻害剤
• 第1相試験の結果は、FB2001が一般的に安全で忍容性が高いことを示唆。中国人と米国人の人種間における有意差は認められなかった。血漿中の単剤抗ウイルス濃度が、薬物動態エンハンサーを使用することなく肺組織に作用するため、薬物相互作用のリスクを最小限に抑える可能性を有する
• 同剤はマウスモデルの肺と脳におけるコロナウイルスの量を大幅に減少させる。後者は、新型コロナウイルスの中枢神経系の後遺症に臨床的な影響を与える可能性を有する。 承認されれば、FB2001は脳内の抗ウイルス活性を報告する最初の抗新型コロナウイルス剤となる。
• COVID-19による入院患者の回復までの時間短縮におけるFB2001有用性を評価する第2/3相試験であるBRIGHT(Bofutrelvir in Global Hospitalized Patients)研究を開始
【アトランタ2022年8月15日PR Newswire】
急性および長期COVIDの治療の基礎を築く
患者の健康を増進する革新的医薬品の発見、開発、普及に注力しているバイオ医薬品企業Frontier Biotechnologiesは、当社の医薬品候補である低分子コロナウイルスメインプロテアーゼ(Mpro)阻害剤FB2001の、健康な成人ボランティアを対象とした第1相臨床試験において良好な結果が得られたことをお知らせします。
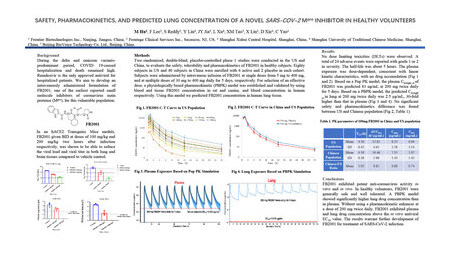
第11回International Conference on Emerging Infectious Diseases(ICEID、新興感染症国際会議)のポスターセッションで発表されたデータは、FB2001が本試験参加者間において安全性および忍容性が高いことを示しました。試験中に報告された有害事象は、ほとんどが軽度から中等度で、中国と米国の研究施設の参加者の間に有意差は認められませんでした。
Frontier Biotechnologiesの最高経営責任者(CEO)であるCJ Wang博士は「FB2001の第1相試験で良好な試験結果が得られたことをうれしく思います。これは、当社およびヘルスケア業界にとって重要なマイルストーンです。この有望な結果は、後期臨床試験の成功に向けた当社の取り組みを加速させるものです。本研究は、中国および海外におけるCOVID-19との闘いにおける当社の取り組みを高めるものです」と述べています。。
本試験は、計120人の参加者(在米国白人80人、在中国中国人40人)に、1日に5mgから400mgまでいずれかの用量のFB2001を単回、または30mgから400mgまでのいずれかの用量のFB2001を5日間、静脈内投与しました。主な結果は以下の通りです。
• FB2001の安全性と忍容性は1日最大400mgまで認められた
• FB2001は、イン・ビトロ試験において薬物動態エンハンサーを使用することなく、血漿中および肺中での薬物濃度が50%有効濃度(EC50値)を上回った
• 中国人群と米国人群において人種間の有意差は認められなかった
第1相試験の結果は、マウスの肺と脳の両組織においてウイルス量を減少させることが認められたFB2001の非臨床試験のイン・ビボ試験データを裏付けました。非臨床試験で得られた薬物動態データでは、血漿中と比較して肺中のFB2001の濃度が有意に高いことが示されました。サンフランシスコのクエスト・クリニカル・リサーチ医長のJay Lalezari医学博士は「FB2001は、SARS-CoV-2のマウスモデルの肺および脳組織において、薬物動態ブースト薬を必要とせずにイン・ビボ試験での抗ウイルス活性を実証しました。従って、急性COVID-19およびコロナ後遺症の治療薬として非常に有望であり、いずれについても追跡研究で評価される見込みです」と述べました。
【画像:https://kyodonewsprwire.jp/img/202208155107-O1-6lAEf10E】
第11回新興感染症国際会議(ICEID)で発表されたポスター (PRNewsfoto/Frontier Biotechnologies)
現在、静脈内投与型のFB2001は、作用発現が早く、嚥下障害など問題のある入院患者に適しています。当社は、臨床研究機関、地域の規制当局、各地の臨床施設と協力し、世界中の数百の臨床施設で約1200人の入院患者を登録するピボタル第2/3相臨床試験(BRIGHT試験)を開始しました。当社の最高医療責任者のMichael Hu博士は「第1相試験のデータは非常に有望であり、COVID-19で入院した患者の回復までの時間短縮において本剤の有用性を探るピボタル試験を、自信を持って実施しています」と述べています。
当社は、軽度のCovid-19の治療や曝露後の予防用に外来診療現場で使用できるFB2001の肺用製剤も開発中です。FB2001を気道や肺に直接吸入すると、血漿中濃度よりはるかに高い組織濃度が得られるため、作用の発現やウイルスの排除が経口療法より速くなる可能性があります。
▽Frontier Biotechnologiesについて
2013年に設立されたFrontier Biotechnologies Inc.(「Frontier Biotech」)は、グローバルなビジョンとワールドクラスの競争力を持ち、中国に本社を置く実用化を推進するバイオ医薬品企業です。Frontier Biotechは、患者の健康を増進させる革新的医薬品の発見、開発、実用化に取り組んでいます。
画像添付リンク:
Link: http://asianetnews.net/view-attachment?attach-id=427145
(写真説明: 第11回新興感染症国際会議(ICEID)で発表されたポスター)
ソース:Frontier Biotechnologies
(日本語リリース:クライアント提供)
















